Have any questions?
+44 1234 567 890
Institut für Biochemie
Das Institut für Biochemie der MHB übernimmt die Verantwortung für die biochemische Ausbildung der Studierenden und widmet sich der biomedizinischen Laborforschung sowie der Ausbildungsforschung. An der Schnittstelle von Biologie, Chemie und Medizin unterrichten und untersuchen wir die Grundlagen des Lebens auf molekularer Ebene.
Der laborexperimentelle Schwerpunkt der Forschung am Institut für Biochemie liegt auf der detaillierten biochemischen und molekularbiologischen Charakterisierung von Signaltransduktionswegen, die im kardiovaskulären/kardiorenalen System und bei dessen Erkrankungen eine Rolle spielen. Die Motivation für unsere Forschung besteht darin, durch den Erkenntnisgewinn auf biochemischer und molekularer Ebene pathobiologische Prozesse besser zu verstehen und neue Angriffspunkte für diagnostische, präventive und therapeutische Maßnahmen zu identifizieren. Unsere wissenschaftlichen Fragestellungen bearbeiten wir mit einem breiten Methodenspektrum, das von der klassischen Biochemie und Molekularbiologie, über Zellkultur, mikroskopische Verfahren und Histologie bis zur Mausgenetik reicht. Unsere Arbeitsweise zeichnet sich durch eine enge Kooperation mit Kolleg*innen aus den klinischen Fachdisziplinen aus (z.B. der Nephrologie).
Im Rahmen der Ausbildungsforschung untersuchen wir die Theorie-gestützte Konzeption und Durchführung unserer Lehrveranstaltungen und analysieren die Wirksamkeit von Lehrinterventionen. Zielsetzung ist dabei die effektive Gestaltung der Lehre genauso wie die Weiterentwicklung des theoretischen Verständnisses von Lehren und Lernen. Diese Fragestellungen bearbeiten wir mit einer Kombination von qualitativen und quantitativen Methoden.
Das Institut für Biochemie übernimmt mit seinem interdisziplinär zusammengesetzten Team in den Studiengängen der MHB die Verantwortung für die Konzeption und Durchführung der Lehre sowie der Prüfungen in den Fächern Chemie und Biochemie. Das biochemische Spiralcurriculum in den Modellstudiengängen der Human- und Zahnmedizin zeichnet sich durch eine systematische horizontale und vertikale Integration mit den anderen Grundlagen- bzw. den klinischen und klinisch-theoretischen Fächern aus. Wir stellen das Verständnis von Prinzipien und die Anwendung von Konzepten vor den Erwerb von detailliertem Faktenwissen, das in einer sich rasant entwickelnden Fachdisziplin wie der Biochemie immer umfangreicher wird. Unsere Lehrveranstaltungen sind auf exemplarisches Lernen ausgerichtet, didaktisch sorgfältig konzipiert, beinhalten interaktive Gestaltungsmethoden und verknüpfen Präsenzlehre mit E-learning-Elementen. Uns ist es wichtig, eine sichere Lernumgebung zu schaffen, in der Fehler zugelassen werden können und konstruktiv mit Nicht-Wissen umgegangen wird.
News
|
Im Vergleich zu Kontrollpersonen haben AKI-Patient*innen signifikant höhere Nostrin-Level im Serum und die Nostrin-Level nehmen mit dem Schweregrad einer AKI signifikant zu. Niedrige Serum Nostrin-Level zum Zeitpunkt einer AKI-Diagnose sind prädiktiv für Überleben im Krankenhaus. In einem translationalen Forschungsansatz konnte das Institut für Biochemie der MHB zusammen mit der Klinik für Nephrologie des Universitätsklinikums Brandenburg das F-BAR Protein Nostrin als einen neuen prädiktiven Biomarker für AKI-assoziierte Mortalität, Notwendigkeit einer Nierenersatztherapie und Wiederherstellung der Nierenfunktion identifizieren. Link zu Erfurt et al. (2024) PLOS ONE
|
|
Dr. Jenny Engelmann (links), wissenschaftliche Mitarbeiterin des Instituts für Biochemie, wurde beim diesjährigen Sommerfest zum zweiten Mal in Folge mit dem 1. Platz des durch die MedSI verliehenen Lehrpreises ausgezeichnet. Der einmal im Jahr vergebene Lehrpreis soll Dozierende auszeichnen, die aus Sicht der Studierenden besonders positiv aufgefallen sind. Dabei hoben die Studierenden bei Dr. Engelmann insbesondere das gute Erklären komplexer biochemischer Zusammenhänge und die gute praktische Lehre hervor. Den 2. Platz des Lehrpreises 2023 holte Magdalena Ruppert (rechts), wissenschaftliche Mitarbeiterin des Instituts für Anatomie.
|
|
|
Für sein Poster „AKI-Risikoprädiktion mittels Serum-Nostrin“ erhielt Stefan Erfurt als medizinischer Doktorand des Instituts für Biochemie und der Klinik für Nephrologie den Preis für das beste Poster im Rahmen des 3. MHB- Alternssymposiums des Zentrums für Alternsforschung (ZAF-BB) der MHB.
|
|
Forschungsprojekte
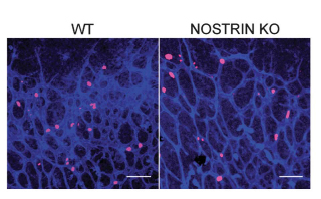
Wir untersuchen Signaltransduktionswege im Kontext kardiovaskulärer Erkrankungen. Ausgangspunkt sind dabei unsere grundlegenden Arbeiten zum F-BAR Protein NOSTRIN. NOSTRIN ist ein wichtiger Regulator der Stickstoffmonoxid (NO)-Produktion und der Verlust von NOSTRIN in knockout-Mäusen führt zu endothelialer Dysfunktion, Hypertension und Herzversagen. Dabei spielt NOSTRIN eine wichtige Rolle in der korrekten Positionierung des M3-Acetylcholinrezeptors. Mit diesen Arbeiten konnten wir NOSTRIN als erstem F-BAR Protein eine Funktion bei der Regulation eines G-Protein gekoppelten Rezeptors nachweisen und zum grundlegenden Verständnis der Funktion von F-BAR Proteinen beitragen (Kovacevic et al., 2012, Embo J.; Kovacevic et al., 2015, Circ. Res.).
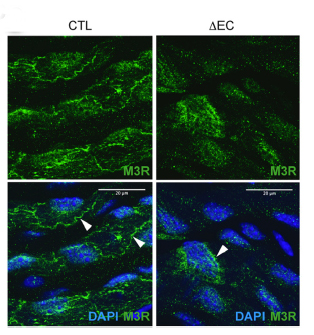
Endothelzellen spielen eine entscheidende Rolle beim Prozess der Angiogenese zur Bildung von neuen Blutgefäßen aus bereits existierenden Gefäßen. Diese Prozesse sind zum einen in der Entwicklung von großer Bedeutung aber auch bei der Wundheilung und Angiogenese von Tumoren. Wir konnten zeigen, dass NOSTRIN an der Assemblierung eines Signalkomplexes bestehend aus dem FGF-Rezeptor 1 mit Rac1 und Sos1 beteiligt ist und dabei essentiell für die FGF-2 abhängige Aktivierung der kleinen GTPase Rac1 ist. Somit kommt NOSTRIN eine wichtige Rolle bei der Angiogenese während der Embryonalentwicklung zu (Kovacevic et al., 2012, Embo J).
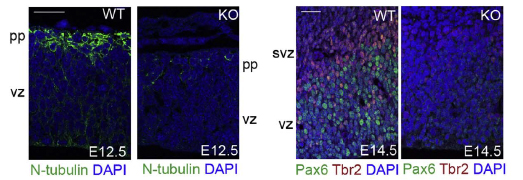
Die Holoprosenzephalie (HPE) ist eine häufige Fehlbildung des Gehirns beim Menschen mit einer Prävalenz von 1:16.000 bei der Geburt und 1:250 beim Embryo. Die Ursachen der HPE können vielfältig sein und an der Entstehung des Krankheitsbilds sind sowohl Einflüsse aus der Umwelt als auch genetische Faktoren beteiligt. Wir konnten die E3-Ligase NOSIP als kritischen Modulator bei der Gehirn- und Gesichtsentwicklung identifizieren. Der Verlust von NOSIP im Mausmodell führt zur Ausbildung einer HPE in Assoziation mit weiteren Fehlbildungen des Gesichts (Hoffmeister et al., 2014, PlosOne). Weiterführende Studien in Maus und Xenopus haben gezeigt, dass NOSIP ein kritischer Faktor für die Neurogenese während der Embryonalentwicklung ist und somit ein Kandidatengen für mögliche Fehlregulationen bei der Entwicklung des menschlichen Gehirns darstellt (Hoffmeister et al., 2017, Dev Biol). Diese Untersuchungen vertiefen und erweitern wir gegenwärtig unter Anwendung von in-vivo und in-vitro Methoden z.B. Kultivierung von neuronalen Stammzellen, Massenspektrometrie, Protein-Protein Interaktionen, intrazelluläre Signalwege auf molekularer Ebene, mikroskopische Methoden.
Virtuelle Lehrformate, wie beispielsweise synchrone Lehrveranstaltungen im Videokonferenzformat, sind zunehmend Teil der medizinischen Aus-, Fort- und Weiterbildung. Die kognitive Beteiligung von Lernenden in diesen Lehrveranstaltungen ist oft schwer einschätzbar, da aufgrund von ausgeschalteten Kameras der Teilnehmenden häufig ein visuelles Feedback für die Dozierenden fehlt.
In unserer Ausbildungsforschungsstudie VeLLeVi untersuchen wir theoriegeleitet, welche Verhaltensweisen bei Studierenden während Lehrveranstaltungen im Videokonferenzformat durch unterschiedliche didaktische Elemente hervorgerufen werden und wie virtuelle Lehrveranstaltungen konzipiert werden können, um Studierende zu motivieren und auf die Veranstaltung zu fokussieren. Dafür erheben und analysieren wir sowohl qualitative Daten (Interviews mit Studierenden) als auch quantitative Daten (Umfragen).
Virtuelle Lehrformate, wie beispielsweise inverted classroom Formate mit asynchronen Lernvideos, werden zunehmend in der medizinischen Aus-, Fort- und Weiterbildung eingesetzt. Solche Formate können z.B. Lernenden die Möglichkeit bieten, über Lernumgebung und -tempo selbst zu entscheiden, aber auch die Durchführung der Lehre an dezentral organisierten Bildungseinrichtungen, wie der MHB unterstützen. Nach aktuellem Stand der Lehr-/Lernforschung steigern Lehrmethoden, welche die Lernenden zur aktiven Mitarbeit anregen, deren Motivation und Lernerfolg. Auch in Lernvideos können solche aktivierenden Elemente integriert werden, anders als in synchronen Präsenzveranstaltungen ist es bei solchen Formaten jedoch unmöglich, die kognitive Beteiligung der Lernenden zu beobachten und so zu erfassen.
Im durch die Interne Forschungsförderung der MHB geförderten Ausbildungsforschungsprojekt VeLLaLe untersuchen wir theoriegeleitet, ob Lernende durch aktivierende didaktische Elemente innerhalb von Lernvideos (H5P) tatsächlich zur aktiven Mitarbeit angeregt werden und welche Verhaltensweisen durch unterschiedliche didaktische Elemente hervorgerufen werden. Dafür erheben und analysieren wir sowohl qualitative Daten (Interviews mit Studierenden) als auch quantitative Daten (Umfragen).
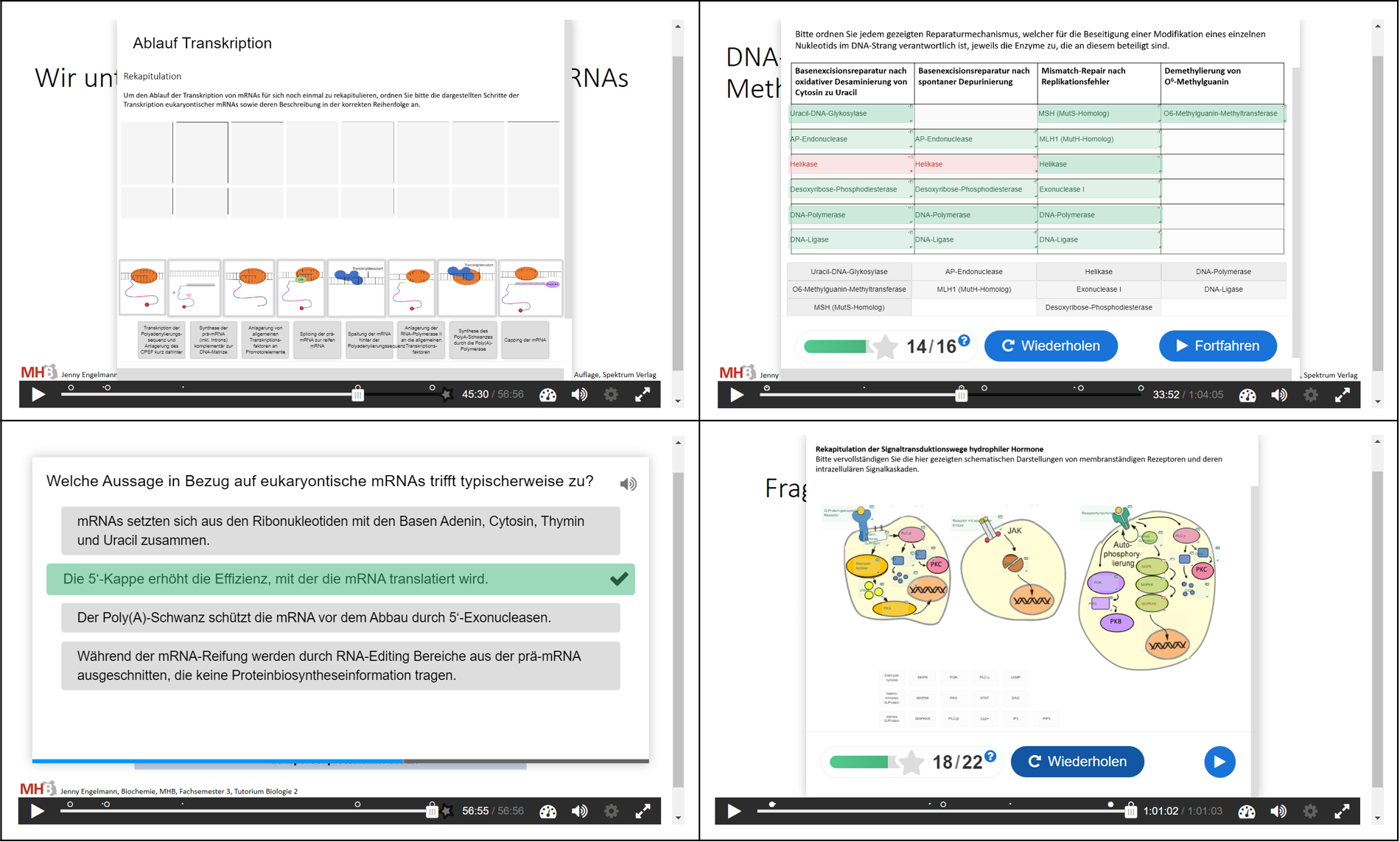
Beispiele für aktivierende didaktische Elemente innerhalb von asynchronen Biochemie-Lernvideos im BMM.
Kontakt
Institut für Biochemie
Campus Neuruppin
Medizinische Hochschule Brandenburg Theodor Fontane
Haus D
Fehrbelliner Str. 38
16816 Neuruppin
E-Mail: biochemie@mhb-fontane.de
Institut für Biochemie
Campus Brandenburg
Medizinische Hochschule Brandenburg Theodor Fontane
Haus 11
Hochstraße 29
14770 Brandenburg an der Havel
E-Mail: biochemie@mhb-fontane.de













